这三天在JYL老师实验室学习了很多,师兄人是真不错
Lablog
文献阅读
农杆菌转化——delta-zein
1.2004年Won-Seok Kim和Hari B. Krishnan发表在Plant Biotechnology Journal的一篇文章。
作者把11 kDa methionine-rich delta-zein通过农杆菌转化到大豆种子中,希望提升大豆种子中含硫氨基酸含量但是失败了。
2.质粒构建使用了β-conglycinin α′-promoter,potato proteinase inhibitor gene 的terminator sequences中间夹TP,即β-conglycinin β-subunit transit peptide δ-zein。后面就接着cauliflower mosaic virus 35S promoter,非特异地在各个器官表达,bar抗除草剂基因和 nopaline synthase gene。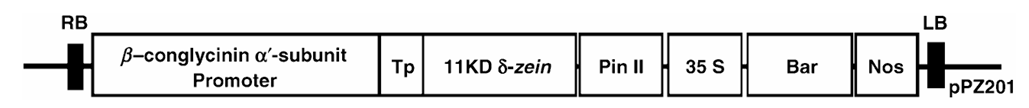
3.做了Northern、Western确定有;各个器官做Northern、Western确认特异性。水溶部分、醇溶部分、总蛋白分别做Western确定保持了zein蛋白的醇溶性,而且发现醇溶部分确实增加了1.5-1.7倍,但是总量并没明显增加。分子克隆时在信号肽和δ-zein中有个突变位点,让成熟的δ-zein蛋白多了两个氨基酸,Western可以看出比阳性对照稍大。比较cDNA和N端序列找到了成熟δ-zein和信号肽裂解位点。确实两个加入的氨基酸在裂解位点之后。原位杂交说正义链反义链都有信号是非特异性的,但是反义链可以发现在维管束边上,这个结果居然能发出来。免疫组化染色先发现确实在维管束边上,又发现两种新蛋白体prontein body。然后又做了金颗粒的冷冻电镜给出这两种的结构。
4.讨论就以后写吧
More info: 不知道是不是原出处反正挂个链接
PCR
移液枪的使用:只能从大往小调;上枪头旋转一下;精密实验时可以反向加液;
做一次10μL的PCR,用2x的试剂,2.5μL的双蒸水,2μL模板,正反引物各0.5μL,然后丢到PCR仪里面预设好温度跑。同时配胶,一片小胶2.5g纯琼脂糖(比配培养基的好),缓冲液25mL(10:1),小心倒防止梳子处有气泡(如有,用手划拉掉)。注意EB污染区手套不能碰其它地方,也不能碰到自己,更不能不带专用手套在EB污染区操作。上样,如果后续要切胶就得上在右边。放到显色仪里面,先用白光摆好位置,再换UV拍照。(师兄跟我讲话去了导致有一条道引物加错了hhh)